Hurtig implementering af flowcytometer designs ved hjælp af dataindsamlingsmoduler med høj nøjagtighed
Bidraget af DigiKeys nordamerikanske redaktører
2022-04-21
Flowcytometri anvendes i vid udstrækning af klinikere og diagnostikere til at analysere cellekarakteristika. En celle ad gangen evaluerer de optisk proteinniveauer, blodets sundhed, granularitet og cellestørrelse blandt andre egenskaber. Selv om de er meget følsomme systemer, er designere af cytometre under konstant pres for at fremskynde analysetiden, hvilket kræver nye tilgange til både flowcytometri og den tilhørende elektronik.
Cytometre udsætter individuelle celler for laserlys for at skabe spredte og fluorescenssignaler. For hurtigt og præcist at opfange det resulterende lys og konvertere det til digitale signaler kræves en avalanche-fotodiode (APD) og kompleks elektronik. Det kan tage lang tid at designe og implementere kredsløbene til denne proces, især fordi indsamlingssystemer til flowcytometridata kræver højhastighedsudstyr med lav støj for at sikre systemets nøjagtighed.
For at understøtte hurtigere flowcytometrianalyser på en omkostningseffektiv måde kan designere løse problemerne med hastighed og nøjagtighed med en dataindsamlingsløsning, der omfatter interne forstærkerdrivere og en analog-til-digital-konverter (ADC).
Denne artikel vil kort vise, hvordan flowcytometriesystemer fungerer. Derefter introduceres Analog Devices' ADAQ23878, et 18-bit ADC-modul, og det vises, hvordan det kan bruges til at designe et flowcytometer-detektions- og konverteringsstadie. Der vil også blive indført et tilhørende evalueringssæt.
Moderne principper for flowcytometri
Moderne flowcytometri er en automatiseret proces, der analyserer celle- og overflademolekyler, karakteriserer og definerer forskellige celletyper i en heterogen cellepopulation. Hvis man ikke medregner forberedelsestiden, som kan være mere end en time, udfører instrumentet en tre til seks karakteristiske vurderinger af 10.000 enkeltceller på mindre end et minut.
For at muliggøre dette er flowcytometriens enkeltcelle præpareringstrin afgørende. Organiseringen af prøverne sker hydrodynamisk i en kappevæske for at fokusere celler eller partikler i en smal, enkeltcellelinjeprøvestrøm med henblik på analyse. Ved denne omdannelse skal de enkelte celler bevare deres naturlige biologiske egenskaber og biokemiske komponenter.
Figur 1 viser et diagram over et flowcytometerinstrument, der starter øverst med en prøve med flere celler.
 Figur 1: Diagram over et flowcytometer, fra fokusering af hylster til dataindsamling. (Billedkilde: Wikipedia, ændret af Bonnie Baker)
Figur 1: Diagram over et flowcytometer, fra fokusering af hylster til dataindsamling. (Billedkilde: Wikipedia, ændret af Bonnie Baker)
De seks hovedkomponenter i flowcytometeret er en flowcelle, en laser, en avalanche-fotodiode (APD), en transimpedansforstærker (TIA), en ADC og en computer til dataindsamling og analyse.
Flowcytometeret har en væskestrøm eller kappevæske, som er indsnævret for at føre og tilpasse cellerne i en enkelt række gennem lysstrålen. Laserlyset fanger en celle ad gangen og skaber et FSC-signal (forward-scattered lys) og et SSC-signal (side-scattered lys). Fluorescenslyset sorteres ved hjælp af spejle og filtre og forstærkes derefter af en APD.
Det næste trin er at detektere, digitalisere og analysere det resulterende lys, efter at det rammer APD'en. Til detektion er Analog Devices LTC6268 500 megahertz (MHz) FET-indgangsopforstærker med ultra lav biasstrøm og lav spændingsstøj med FET-indgang til 500 megahertz (MHz) ideel til den højhastigheds-TIA, der er nødvendig til detektion.
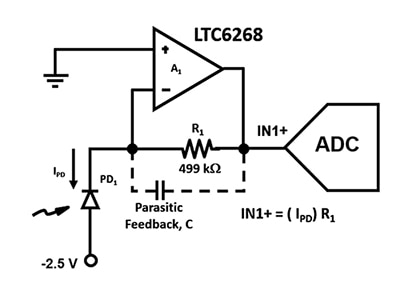 Figur 2: TIA-kredsløbet anvender en APD (PD1) og en FET-opforstærker med lav indgangsstrøm til at konvertere ultralave fotodiode strømme til en udgangsspænding ved IN1+. (Billedkilde: Bonnie Baker)
Figur 2: TIA-kredsløbet anvender en APD (PD1) og en FET-opforstærker med lav indgangsstrøm til at konvertere ultralave fotodiode strømme til en udgangsspænding ved IN1+. (Billedkilde: Bonnie Baker)
Det er vigtigt at designe dette forstærker kredsløb med den størst mulige båndbredde, så parasitære kapacitanser skal minimeres. F.eks. påvirker den parasitære feedback kapacitans, C, stabiliteten og båndbredden i figur 2's kredsløb. Uanset valget af modstandspakke vil der altid være en parasitær kapacitet i forstærkerens tilbagekoblingsvej. En 0805-pakning, som har en længere afstand mellem endekapperne og den laveste parasitære kapacitet, er dog at foretrække til højhastighedsapplikationer.
Forøgelse af afstanden mellem R1's endekapper er ikke den eneste måde at reducere kapacitansen på. En anden måde at reducere kapacitansen fra plade til plade på er at afskærme de E-feltbaner, der giver anledning til den parasitære kapacitet, ved at placere en ekstra jordforbindelse under modstanden R1 (Figur 3).
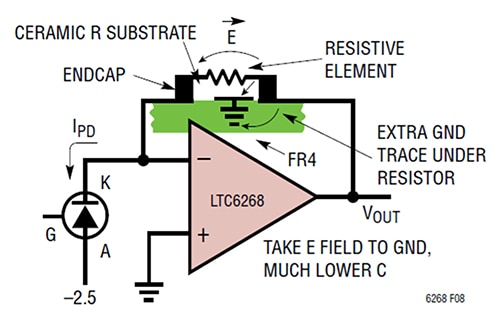 Figur 3: Tilføjelse af en jordforbindelse under tilbagekoblingsmodstanden shunter E-feltet væk fra tilbagekoblingssiden og dumper det til jord. (Billedkilde: Analog Devices)
Figur 3: Tilføjelse af en jordforbindelse under tilbagekoblingsmodstanden shunter E-feltet væk fra tilbagekoblingssiden og dumper det til jord. (Billedkilde: Analog Devices)
I dette tilfælde indebærer metoden specifikt at placere et kort jordforbindelse under og mellem modstandspuderne nær TIA'ens udgangsside. Denne teknik giver en parasitær kapacitansværdi på 0,028 picofarads (pF) med en TIA-båndbredde på 1/(2π*RF*CPARASITIC), svarende til 11,4 MHz.
De optiske lyssignaler peger mod flere avalanche dioder med passende optiske filtre. APD-, TIA- og ADC-systemet konverterer disse signaler til deres digitale repræsentation og sender dataene til mikroprocessoren til yderligere analyse.
Moderne instrumenter har normalt flere lasere og APD'er. De nuværende kommercielle apparater har ti lasere og tredive avalance-fotodioder. Ved at øge antallet af laser- og fotomultiplikatordetektorer kan man ved hjælp af flere antistofmærkninger præcist identificere målpopulationer ved hjælp af fænotypiske markører.
Analysens hastighed afhænger dog af en fin balance mellem:
- Kappe væskehastigheden
- Den hydrodynamiske fokuseringsproces' evne til at danne enkeltcellelinjer
- Tunneldiameteren
- Evnen til at bevare en celles integritet
- Elektronikken
Akustisk fokusering ved flowcytometri
Selv om tilføjelse af flere lasere og APD'er fremskynder analyse og identifikation, kan de nyeste moderne flowcytometrimetoder til enkeltceller i bedste fald indsamle data om op til en million individuelle celler pr. minut. I mange anvendelser, f.eks. til påvisning af cirkulerende tumorceller i blodet i niveauer på helt ned til 100 celler pr. milliliter, er dette utilstrækkeligt. I kliniske anvendelser med sjældne celler kræver test regelmæssigt tidskrævende analyser af milliarder af celler.
Alternativet til den hydrodynamisk fokuserede cellepræparationsproces er en akustisk fokuseringsproces. Her er et piezoelektrisk materiale, f.eks. blyzirconattitanat (PZT), fastgjort til en glaskapillær for at omdanne elektriske impulser til mekaniske vibrationer (figur 4a). Ved at bruge en PZT til at vibrere sidevæggene af en glaskapillær ved den rektangulære flowcelles resonansfrekvens genererer systemet en række forskellige akustiske stående bølger med varierende antal trykknuder.
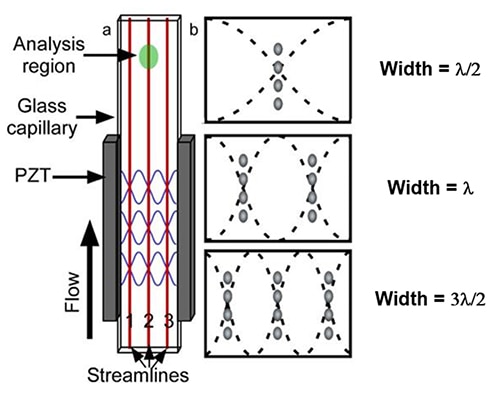 Figur 4: Illustration af en akustisk flowcelle fremstillet med en rektangulær glaskapillær (a). Placeringen af de tre første trykknudepunkter for en kapillær med fast bredde (b). (Billedkilde: National Center for Biotechnology Information)
Figur 4: Illustration af en akustisk flowcelle fremstillet med en rektangulær glaskapillær (a). Placeringen af de tre første trykknudepunkter for en kapillær med fast bredde (b). (Billedkilde: National Center for Biotechnology Information)
Disse PZT-frekvensknuder tilpasser de strømmende partikler i flere diskrete strømlinjer (figur 4b). Den akustiske flowcelle bruger en lineær, stående akustisk bølge til at indstille sig på forskellige bølgelængder ved at skabe enkelte eller flere overtoner. Som forudsagt af den simple lineære stående bølgemodel danner cellerne i prøven enkelte eller mange enkeltcellelinjer i flowkammeret.
Med denne præcise organisering af cellerne kan bredden af strøm kappetunnelen udvides for at tillade hurtigere strømningshastigheder forbi laserstrålen (Figur 5).
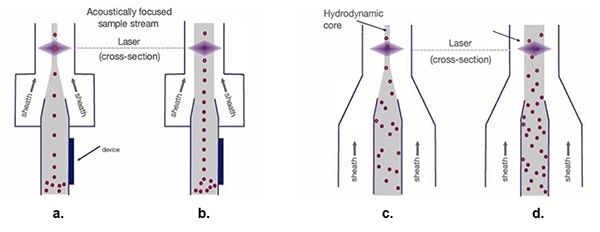 Figur 5: Med den hydrodynamiske prøvestrøm (c. og d.), spredes celleprøverne, efterhånden som kappens bredde øges, hvilket vanskeliggør den optiske målingsproces. Akustisk fokuserede prøvestrømme (a. og b.) bevarer cellerne i en enkelt linje uanset kappens bredde. (Billedkilde: Thermo Fischer Scientific)
Figur 5: Med den hydrodynamiske prøvestrøm (c. og d.), spredes celleprøverne, efterhånden som kappens bredde øges, hvilket vanskeliggør den optiske målingsproces. Akustisk fokuserede prøvestrømme (a. og b.) bevarer cellerne i en enkelt linje uanset kappens bredde. (Billedkilde: Thermo Fischer Scientific)
Ved traditionel hydrodynamisk fokusering (figur 5c.) arrangeres enkeltcellelinjerne som forberedelse til laserscanning. Mens en bredere tragt til prøvestrømmens kerne giver mulighed for en højere hastighed af kappematerialet (figur 5d.), resulterer det også i en spredning af enkeltcellens organisation, hvilket giver signalvariation og kompromitteret datakvalitet.
Akustisk fokusering (figur 5a.) placerer biologiske celler og andre partikler i nøje overensstemmelse med hinanden, selv med en bredere tunnel. Denne præcise cellejustering giver mulighed for højere prøvetagningshastigheder, samtidig med at datakvaliteten opretholdes (Figur 5b.).
I praksis øger akustisk fokusering ved flowcytometri akustisk fokusering celleprøvetagningsfrekvensen med ~20x (figur 6).
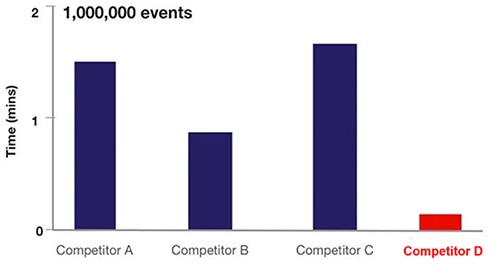 Figur 6: Sammenligning af prøveudtagningstiden for forskellige flowcytometrier baseret på væskeflowcytometri (A, B, C) versus akustisk fokuseringscytometri (D). (Billedkilde: Thermo Fischer Scientific)
Figur 6: Sammenligning af prøveudtagningstiden for forskellige flowcytometrier baseret på væskeflowcytometri (A, B, C) versus akustisk fokuseringscytometri (D). (Billedkilde: Thermo Fischer Scientific)
I figur 6 bruger udstyr fra A, B og C hydrodynamisk teknologi, mens D bruger den akustiske fokuserende cytometri-flowmetode.
Akustisk fokusering af flowcytometridataindsamling
Udformningen af elektronikken i udstyr til akustisk fokusering af flowcytometriudstyr kræver højhastigheds-fotosensorelektronik til at kunne håndtere blodcellernes og kappens væskehastighed gennem dysen med større diameter. Den tidligere nævnte LTC6268 med høj hastighed på 600 MHz i kombination med et specialiseret 0805-modstandspakkelayout bringer den optiske aftastningshastighed op til 11,4 MHz (Figur 7, venstre). Udgangen fra LTC6268 føres til en Analog Devices ADAQ23878 ADC til digitalisering.
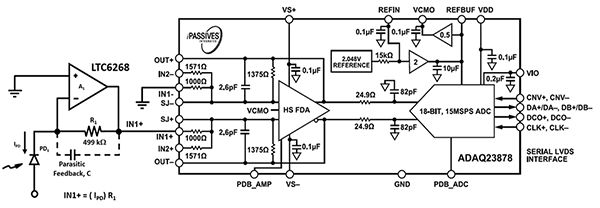 Figur 7: ADAQ23878 ADC'en digitaliserer det optiske signal fra fotodioden (PD1) og TIA-kredsløbet (til venstre). (Billedkilde: Bonnie Baker)
Figur 7: ADAQ23878 ADC'en digitaliserer det optiske signal fra fotodioden (PD1) og TIA-kredsløbet (til venstre). (Billedkilde: Bonnie Baker)
ADAQ23878 er en 18-bit, 15 megasamples pr. sekund (MSPS), præcisions-, højhastigheds system-in-package (SIP) dataindsamlingsløsning. Det reducerer i høj grad udviklingscyklussen for præcisionsmålesystemer ved at overføre designbyrden i forbindelse med valg, optimering og layout af inputdriverkomponenter fra designeren til enheden.
SIP's modulære tilgang reducerer antallet af komponenter i slutsystemet ved at kombinere flere fælles signalbehandlings- og konditioneringsblokke i en enkelt enhed sammen med den hurtige 18-bit, 15 MSPS successive approximationsregister (SAR) ADC med høj hastighed (18-bit, 15 MSPS). Disse blokke omfatter en støjsvag, fuldt differentiel ADC-driverforstærker og en stabil referencebuffer.
ADAQ23878 indeholder også de kritiske passive komponenter, der anvender Analog Devices iPassive-teknologi for at minimere temperaturafhængige fejlkilder og optimere ydeevnen. ADC'ens drivertrin med hurtig afvikling bidrager til dens evne til at sikre hurtig dataindsamling.
Evaluering af ADAQ23878 µModulet
For at evaluere ADAQ23878 tilbyder Analog Devices evalueringskortet EVAL-ADAQ23878FMCZ (Figur 8). Kortet demonstrerer ydelsen af ADAQ23878 μModulet og er et alsidigt værktøj til evaluering af et flowcytometri front-end design og en række andre applikationer.
 Figur 8: EVAL-ADAQ23878FMCZ-evalueringskortet til ADAQ23878 har strømkredsløb på kortet, leveres med tilhørende software til styring og dataanalyse og er SDP-H1-kompatibelt. (Billedkilde: Analog Devices)
Figur 8: EVAL-ADAQ23878FMCZ-evalueringskortet til ADAQ23878 har strømkredsløb på kortet, leveres med tilhørende software til styring og dataanalyse og er SDP-H1-kompatibelt. (Billedkilde: Analog Devices)
EVAL-ADAQ23878FMCZ-evalueringskortet kræver en pc med Windows 10 eller højere, en støjsvag præcisionssignalkilde og et båndpasfilter, der er egnet til 18-bit testning. Evalueringskortet har brug for ADAQ23878 ACE-plugin og SPD-H1-driver.
Konklusion
Undersøgelse af en biologisk celle ad gangen ved hjælp af standard hydrodynamiske fokus-flowcytometri-teknikker har været en succes, men med behovet for hurtigere analyser er der sket et skift til teknikker baseret på akustiske fokus-flowmetoder. Men elektronikken, der understøtter mere avanceret flowcytometri, skal også forbedres, samtidig med at plads, omkostninger og udviklingstid minimeres.
Som vist kan LTC6268-op-forstærkeren med høj hastighed og ADAQ233878-dataindsamlingsløsningen med høj præcision, høj hastighed og μModul kombineres for at skabe et komplet dataindsamlingssystem til avanceret udstyr til flowcytometri.

Disclaimer: The opinions, beliefs, and viewpoints expressed by the various authors and/or forum participants on this website do not necessarily reflect the opinions, beliefs, and viewpoints of DigiKey or official policies of DigiKey.







